Teil 2: Vorbereitung der Proben
Teil 2: Vorbereitung der Proben
Einleitung
In diesem Teil meiner Serie möchte ich den allgemeinen Gebrauch des Wasserimmersions-Objektivs beschreiben, die Vorbereitung des Präparats und die Immersion des Objektivs.
Alle Teile der Serie:
- Teil 1: Die Reinigung
- Teil 2: Vorbereitung der Proben
- Teil 3: Hochaufgelöste Bilder mit schiefer Beleuchtung im Hellfeld (in Vorbereitung)
Das Wasserimmersions-Objektiv
Wasserimmersion-Objektive sind spezielle Objektive, welche optimiert sind für die Beobachtung von Proben in wässrigem Medium, etwa Zellkulturen, Planktonproben, Hefekulturen oder Proben von Pilzgewebe und frischen Schnitten von Pflanzengewebe, die idealerweise in Wasser präpariert werden sollen. Bei dieser Einbettung in Wasser oder der Entnahme von Proben in Fundortwasser tritt bei Trockenobjektiven oder Ölimmersionsoptiken ein optischer Fehler auf, den man sphärische Aberration nennt. Dabei werden die Lichtstrahlen beim Übergang von Luft in das Deckglas und anschließend im wässrigen Medium unterschiedlich gebrochen und abgelenkt, so dass man mit zunehmender Tiefe nur noch ein verschwommenes Bild erhält. Der Umstand wird behoben mit einem Trick: Man konstruiert und korrigiert das Objektiv derart, dass zwischen dem Deckglas und dem Objektiv ebenfalls Wasser benutzt wird. Die geniale Idee der Wasserimmersion wurde bereits um 1850 von Hartnack umgesetzt in seinen ersten Objektiven. Später boten auch andere optische Firmen solche Objektive an. Anstelle durch einen Luftspalt zu blicken, taucht das Objektiv in einen Tropfen destilliertem Wasser und die Lichtstrahlen verlaufen nun ausgehend vom Objektiv bis zum Objekt im Präparat so, wie sie auch in der Probe weiter verlaufen. Auf diese Weise wird der im Medium (nicht im Objektiv) auftretende optische Fehler korrigiert und man erhält auch in tieferen Schichten der Probe ein scharfes Bild mit hohen Kontrast.
Einfache Tauchobjektive
Sogenannte Eintauchobjektive, sind Wasserimmersions-Objektive, welche für das aufrechte Mikroskop und die Beobachtung ohne Deckglas konstruiert sind. Eintauchobjektive sind in der Hauptsache für physiologische Untersuchungen und Zellkulturen gedacht, die unbeweglich am Boden eines Kulturglases oder einer Petrischale haften. Bei der Beobachtung ohne Deckglas sind die Proben in gewisser Weise noch für Manipulationen zugänglich, etwa die Injektion von Substanzen in Zellen. Einige ältere aber auch moderne Multi-Immersionsobjektive geringer Vergrößerung gestatten die Beobachtung ohne Deckglas. Sie besitzen einen Korrekturring, mit dem man die Deckglasdicke auf die Nullstellung bringen kann, das heißt für die Beobachtung ohne Deckglas. Spezielle Objektive für physiologische Beobachtungen besitzen heute jedoch eine Kunststoffhülle, die das Objektiv vor Korrosion im verwendeten Kulturmedium schützen.
Die Probenvorbereitung ist bei der Beobachtung ohne Deckglas besonders einfach: Man führt das Objektiv in die Kulturlösung ein, bis die Zellkultur am Boden der Petrischale scharf erscheint. Für die Beobachtung von planktonischen Bewohnern, hauptsächlich Kleinkrebsen, Würmern und Einzellern, ist das Tauchobjektiv allerdings nicht gut geeignet. Eintauchobjektive setzen voraus, dass die Probanden still halten und irgendwo angehaftet sind. Diese Voraussetzungen erfüllen frei schwimmende Mikroorganismen in der Regel nicht. Eher macht man die Erfahrung, dass die beobachteten Organismen während der Bewegung des Präparatetischs oder der Betätigung des Fokustriebs in der Probe zur Seite geschoben werden.
High-End Objektive
Moderne Typen von Wasserimmersions-Objektiven für Life-Cell-Imaging, Konfokalmikroskopie oder Super-Resolution Imaging sind für die Beobachtung mit Deckglas konzipiert. Die Beobachtung mit einem Deckglas bietet mechanisch besser kontrollierbare Bedingungen. Objektive für die Beobachtung mit dem Deckglas besitzen einen Korrektionsring zur Einstellung der Dicke des Deckglases, ähnlich der ursprünglichen Objektive, die einst von Hartnack um 1850 gebaut wurden. Diese hochgezüchteten Objektive bieten heute hinsichtlich Auflösungsvermögen und Kontrast die beste Abbildungsleistung, die man erwarten darf. Mit einer numerischen Apertur von 1,2-1,3 bieten die hoch vergrößernde Objektive höchste Auflösung und Kontrast auch in tieferen Schichten einer wässrigen Probe.
Abbildung: Diese modernen Wasser-Immersionsobjektive mit Vergrößerungen von 25x, 40x und 63x besitzen einen Einstellring zur Anpassung an das verwendete Immersionsmedium und/oder Dicke der verwendeten Deckgläser. Das abgebildete Objektiv 25x (links) ist ein Plan-Apochromat für Multi-Immersion (Wasser, Glyzerin, Öl). Die beiden linken Objektive sind hoch vergrößernden Objektive mit hoher Apertur, die auch über eine eine einstellbare Temperaturkompensation verfügen: C-Apochromat 40x/1,2 W und LCI Plan-Neofluar 63x/1,3 DIC. Die Temperaturkompensation ist gekennzeichnet für Temperaturen von 23°C (schwarz) bis 37 °C (rot). Der C-Apochromat ist ein reines Wasser-Immersionsobjektiv, während die beiden anderen Kandidaten verschiedene Immersionsmedien unterstützen.
Vorbereitung von Objektträger und Deckglas
Bei der Wahl der Objektträger sollte man beim Kauf auf den Verwendungszweck achten. Es gibt beschichtete Objektträger für die Histologie, an denen Schnitte gut haften. Solche sind für Life-Cell-Imaging oder Fluoreszenz-Anwendungen oft ungeeignet. Am besten für Life-Cell Imaging sind einfache Objektträger aus inertem Glas.
Rückstände von der Reinigung oder Biofilme nach längerer Lagerung hinterlassen oft einen Film auf dem Objektträger. Objektträger reinigt man am besten durch Anhauchen und Abreiben mit einem trockenen Reinigungspapier oder Küchenkrepp. Die Reinigung von Objektträgern oder Deckgläsern mit optischen Reinigungsflüssigkeiten, welche Alkohole, organische Lösemittel und/oder Detergenzien und Tenside enthalten, ist bei der Untersuchung lebender Zellen und höherer Organismen zu unterlassen. Bereits geringste Rückstände der Reinigungsmittel werden von den Organismen nicht vertragen. Verschiedene Mikroskopiker berichteten bereits darüber, dass sie getränkte Brillenputztücher zur Reinigung der Objektträger verwendeten und im Anschluss oft beobachteten, dass die Organismen rasch verstarben. Lassen sich Objektträger nicht durch Anhauchen reinigen, verbleiben Filme oder andere Rückstände nach dem erneuten Anhauchen, so sollte man sie wegwerfen. Zeigen neue Objektträger hartnäckige Rückstände von der industriellen Reinigung und sind nicht gut zu reinigen, sollte man von Fall zu Fall ein anderes Fabrikat probieren.
Deckgläser zeigen oft Verschmutzungen durch feinste Glassplitter oder Laborstaub. Man reinigt sie man am besten vor der Präparation, indem man das Deckglas unter Kontrolle mit einer Kopflupe mit einem trockenen Tuch abreibt. Das Tragen von Handschuhen vermeidet Fingerabdrücke und Schnittwunden: Man hält das Deckglas in der einen Hand an der Oberfläche und nicht an den Kanten und zieht mit dem Tuch zwischen den Fingern der anderen Hand von der Mitte nach außen den Staub herunter. Diese Reinigung geht schon bald in Fleisch und Blut über.
Stabilisierung des Deckglases
Beim Immersionsobjektiv wird zwischen Objektiv und Deckglas ein kleiner Tropfen Wasser eingebracht (siehe unten). Ähnlich wie bei der Ölimmersion auch, führt dies dazu, dass die Oberflächenspannung des Wassertropfens zwischen Objektiv und Deckglas beim Verfahren des Probentisches das Deckglas bis zu einem gewissen Grad in alle Richtungen und auch in Richtung der Fokussierung schleppen mit bewegen wird. Dabei wird das Präparat merklich durcheinander gewirbelt und auch die Fokussierung gelingt nicht gut. Die Probanden werden merklich verschoben oder zerreissen gar, wenn sie bereits in Quetschpräparation fixiert sind.
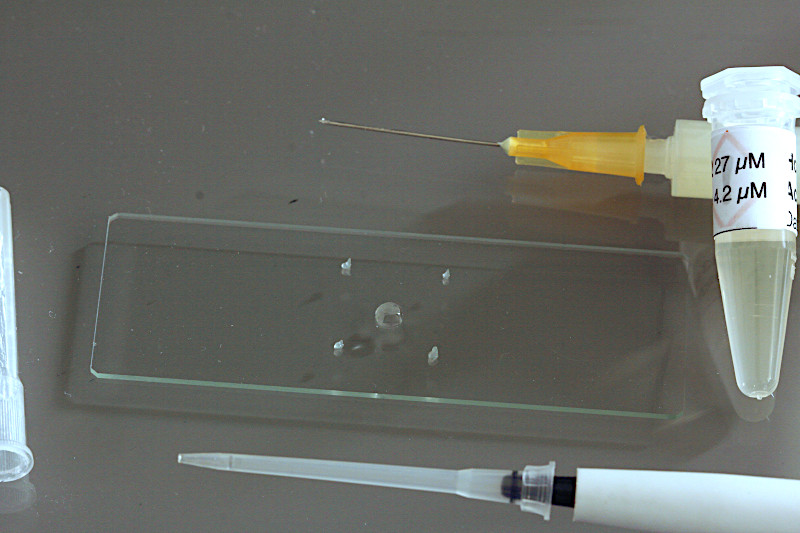
Vaselinefüßchen sind eine einfache Lösung des Problems. Es hat sich zweckmäßig erwiesen die Vaseline mit einer kleinen Spritze von 5ml aufzutragen. Auf diese Weise kann man die Vaseline am besten dosieren. Hier sollen die Arbeitsschritte eines mikroskopischen Präparats einer Fluoreszenzprobe dargestellt werden.
Mit der Injektionsnadel der Spritze gibt man an den vier Ecken des Deckglases vier kleine Tropfen Vasline. Um die Punkte gut zu plazieren kann auch eine gedruckte Schablone aus Papier als Unterlage verwendet werden, auf der die Lage und Maße des Deckglases eingezeichnet sind.
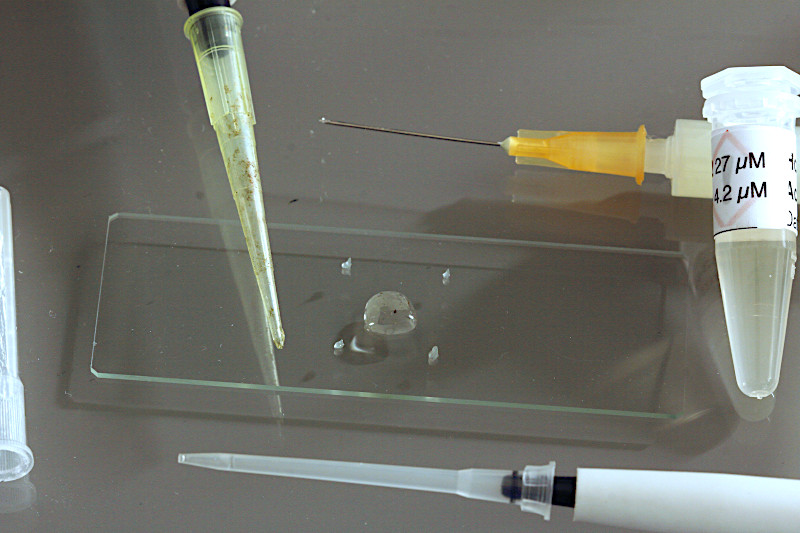
Mit einer einstellbaren Microliterpipette (2-20 µl) wird nun das Probenvolumen mit dem Fluorochrom zuerst aufgetragen (hier 5 µl). Bei einfachen Plankton oder Zellpräparaten ohne Färbung entfällt dieser Schritt.
Mit einer einstellbaren Microliterpipette (20-200 µl) werden nun 25 µl der Probe einer zu untersuchenden Zellkultur oder Planktonprobe aufgetropft. In der Regel trage ich ein Probenvolumen von 25 µl auf. Größere Wimpertiere oder Kleinkrebse erfordern je nach Größe 50-100 µl Probenvolumen.
Im letzten Schritt wird das Deckglas vorsichtig aufgelegt. Nun ist das Präparat bereit für Life-Cell-Imaging mit dem Wasserimmersions-Objektiv.
Immersion des Objektivs
Nachdem das Präparat vorbereitet ist, wird es auf dem Präparatetisch eingespannt. Man schaltet die Mikroskopbeleuchtung ein und köhlert das Mikroskop nach Vorschrift mit einem 10x Trockenobjektiv. Mit einem Objektiv geringer Brennweite beginnt man zunächst das Präparat abzusuchen. Moderne Objektive sind parfokal, d.h. beim Wechsel der Objektive muss nur minimal nachfokussiert werden. Dennoch wird man mit den Wasserimmersionsobjektiven anders arbeiten müssen, da man gelegentlich auch zwischen dem Trockenobjektiv und der Wasserimmersion wechseln möchte.
Bevor man das Wasserimmersions-Objektiv einschwenkt, senkt man den Tischträger zunächst ab. Eine Umdrehung am Grobtrieb sollte genügen. Nun sollte der Arbeitsabstand zwischen dem niedrig vergrößernden Trockenobjektiv und dem Präparat groß genug sein, um mit einer sauberen Pipette einen kleinen Tropfen destilliertes Wasser in dem Lichtkegel auf das Deckglas aufzubringen. Alternativ kann auch das vom Hersteller angebotene Immersol W verwendet werden.
Nun schwenkt man das Wasserimmersionobjektiv ein. Der Tropfen sollte das Objektiv dabei noch nicht berühren.
Nun wird der Tischträger vorsichtig hoch gefahren, bis der Wassertropfen das Objektiv berührt. Da die Hellfeldbeleuchtung des Mikroskops eingeschaltet ist, ist der Moment der Berührung auch an einer Aufhellung des Tropfens gut zu erkennen.
Es ist nicht empfohlen das Wasserimmersionobjektiv von der Seite einzuschwenken, da sich auf diese Weise kleine Luftblasen zwischen Objektiv und Deckglas im Tropfen einstellen können. Diese werden sich sofort störend bemerkbar machen und zu einem unscharfen kontrastarmen Bild führen. Sollte sich dennoch eine Luftblase eingeschlichen haben ist es am besten das Präparat erneut abzusenken, das Objektiv heraus zu schwenken und zu trockenen und mit einem kleinen abgeschnittenen Stück Küchenkrepp oder Papierhandtuch ebenfalls den Rest des Tropfens vom Deckglas abzuziehen. Dann sollte die Prozedur mit einem neuen Tropfen begonnen werden.
Im folgenden und letzten Teil werde ich beschreiben, wie man mit einem modernen, hochauflösenden Wasserimmersions-Objektiv mit Apertur 1,2-1,3 verfährt, um hochaufgelöste Abbildungen im Hellfeld mit schiefer Beleuchtung zu erhalten. Dabei wird der Kondensor eine wichtige Rolle spielen.