Einleitung
Die Imprägnierung mit Silberpräparaten verschiedener Art ist eine seit langem praktizierte Technik zur Dokumentation der vielen Arten von Ciliaten (Phylum: Ciliophora). Erste Publikationen erfolgten durch Klein (1926), nach dem das Klein'sche Silberliniensystem später benannt wurde. Spätere Methoden wurden von vielen Autoren, darunter etwa Chatton & Wloff, Dragesco & Tuffrau, Corliss oder auch Foissner abgewandelt, um nur einige zu benennen. Die verschiedenen Techniken färben dabei verschiedene Strukturen der Zellen an, welche mit dem motorischen Bewegungsapparat der Wimpertiere zusammenhängen, nämlich die Anordnung eines Fibrillensystems, das auch Teil des Bewegungsapparats ist (Foissner, 1969; Foissner 1975), bzw. der Ansätze der Wimpern (Cilien) selbst, als Teil des Basalkörpers.
Methoden der Versilberung
Die verschiedenen Methoden lassen sich grob einteilen in trockene und nasse Versilberungsmethoden. Den Begriff der "trockenen" Versilberung prägte W. Foissner, der die Methode der Klein'schen Versilberung verbesserte, wobei die Wimpertiere zunächst auf einer Schicht Eiweiß durch Trocknung fixiert und anschließend auf nassem chemischem Wege weiter verarbeitet werden. Die nassen Methoden beginnen mit einer Fixierung der Zellen in einer Fixierlösung und lassen sich grob unterteilen in Methoden, welche ammonikalisches Silber oder Silbercarbonat nutzen und die Imprägnierung mit "Protargol". Nicht alle Methoden liefern Dauerpräparate, welche es gestatten Typusmaterial von Fundorten in Bibliotheken der Wissenschaft dauerhaft zugänglich zu machen. Einige Methoden, wie die Silbercarbonatmethode nach Fernandez-Galiano liefern nur ein über wenige Stunden beobachtbares Resultat, das rasch dokumentiert werden muss und ansonsten vergänglich bleibt. Die Methode wurde später von Augustin et al. (1984) abgewandelt, wobei jedoch auch hier darauf hingewiesen wurde, dass ältere Präparate meist nicht mehr so gut erhalten bleiben. Später schreiben Foissner et al. (1991) jedoch hierüber, dass keine wirklich befriedigende Möglichkeit bekannt sei, mit dieser Methode Dauerpräparate anzufertigen.
Trockene Versilberung
Die trockene Methode, wie sie bei Foissner et al. (1991) beschrieben wird, kann von Amateuren mit vertretbarem Aufwand und recht gut angewandt werden. Ich selbst lernte sie zunächst von der Bonner Biologin Catherine Fehse (INRES, Universität Bonn). Kurze Zeit später hatte ich das Vergnügen diese Methode von Wilhelm Foissner selbst zu lernen, der sie im Rahmen einer Veranstaltung in Bodman am Bodensee einem Kreis von Amateuren vorstellte. Die Ciliaten werden dabei auf einer angetrockneten Eiweißschicht auf einem Objektträger aufgeklebt. Hierzu pipettiert man die Wimpertiere aus der Probe heraus, und tropft sie auf das fast trockene, dünn ausgestrichene Hühnereiweiß. Die Fixierung erfolgt nun durch einfaches Trocknen des Objektträgers. Dann werden die Präparate mit Silbernitrat überschichtet, mit einer Lampe oder im Sonnenlicht belichtet, und mit einem Gemisch aus verschiedenen Fotoentwicklern entwickelt. Die originale Rezeptur (Foissner et al., 1991) für den Entwickler funktioniert sehr gut. Schließlich kann das Präparat in Harz eingeschlossen werden. Die trockene Versilberung ist leider nur bei einigen wenigen Gattungen anwendbar, deren Zellen die Trocknung gut überstehen und dabei nicht zerplatzen oder anderweitig entstellt werden.
Nachdem ich einige Arten immer wieder verlor, und auf den angefertigten Präparaten nicht wieder fand, hatte ich den Vorgang der Trockung mikroskopisch kontrolliert. Ich konnte dabei beobachten, dass das verwendete Hühnereiweiß offenbar eine Art "allergischer" Reaktion bei vielen Gattungen auszulösen scheint. Man kann nämlich beobachten, dass nach dem Auftropfen der Probe mit den Wimpertieren, bei empfindlichen Arten offenbar kurz nach dem ersten Kontakt der Tiere mit der aufquellenden, dünnen Schicht Hühnereiweiß auf dem Objektträger ein Absterben und die Auflösung der Zellen begünstigt wird, noch lange bevor sie durch Trocknung fixiert werden können und anhaften. Ursachen sind eventuell ein osmotischer Schock durch die im Hühnereiweiß enthaltenen Salze, die sich nun in der Probe lösen, oder eine Art Eiweißschock. Einige robustere Arten, wie Paramecium sind jedoch auf diese Weise gut zu versilbern.
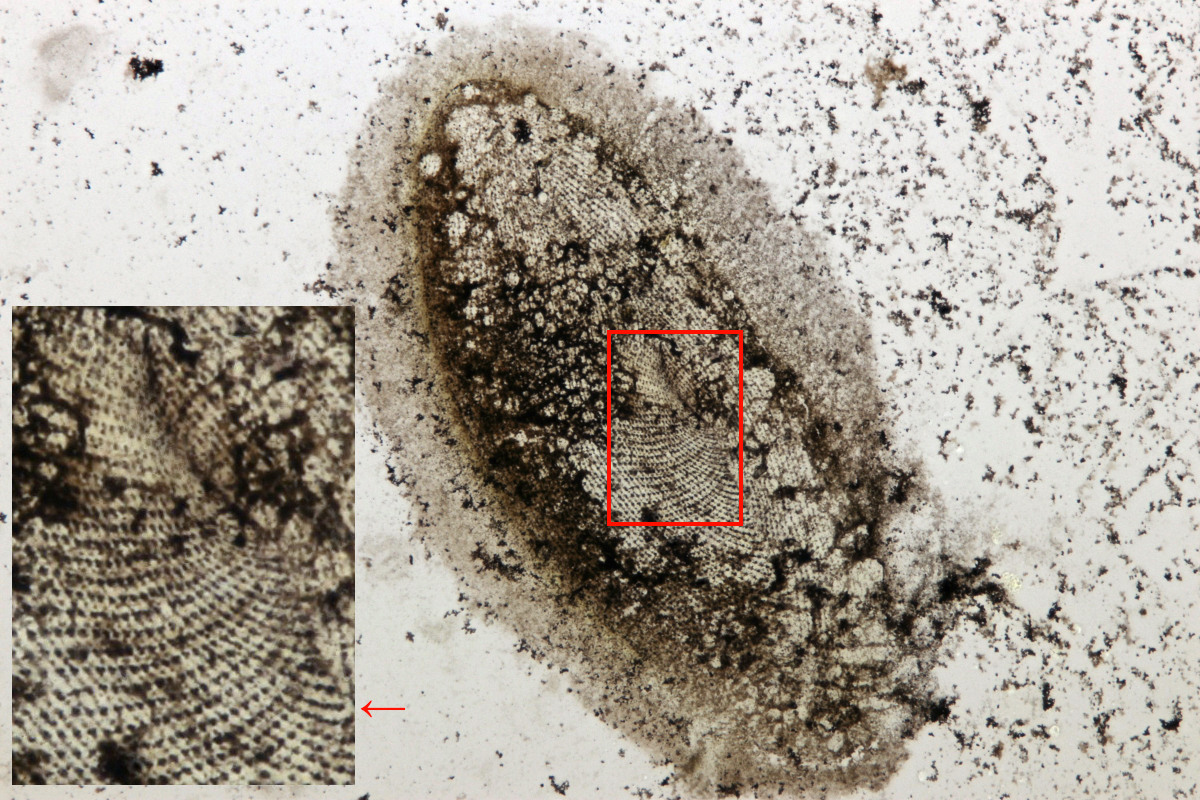
Hier gezeigt werden soll eine Fotografie eines älteren Dauerpräparats des Wimpertiers Paramecium caudatum, dem berühmten Pantoffeltier, bei dem wir zufällig auf das Mundfeld blicken. Oft sind Artefakte mit dieser Methode zu beobachten, wie etwa das gefärbte Hühnereiweiß als graue Umrandung in meiner Aufnahme. Andere Organellen der Wimpertiere, wie etwa gefüllte Nahrungsvakuolen und auch andere Organismen (z.B. Bakterienfilme, Flagellaten, Rädertiere) werden ebenfalls mit versilbert. Die mikroskopische Beobachtung und Interpretation erfordert daher etwas Übung und den Vergleich mit Abbildungen in der Literatur. Typischerweise werden für die Illustrationen wesentliche Strukturen der Ciliaten vom Bild abgezeichnet, ohne die tatsächlich versilberten Artefakte zu berücksichtigen.
Abbildung 1: Das Ergebnis der trockenen Versilberung nach Foissner eines Paramecium caudatum zeigt das Silberliniensystem dieser Art wie einen art-typischen, charakteristischen Fingerabdruck. Fokusstack aus ca. 15 Aufnahmen, Objektiv 40x.
Protargolmethoden
Protargol war der Handelsname eines Silberpräparats, das ab 1897 zu therapeutischen Zwecken mit anti-bakterieller Wirkung eingesetzt wurde. Seine Anwendung zur Imprägnierung des Wimpersystems der Ciliaten ist bis heute eine der wichtigsten Methoden für die Darstellung der Arten. Im Laufe der Zeit wurden verschiedene neue Herstellungsverfahren speziell für die Färbung der Ciliaten beschrieben, wobei sich der Name Protargol erhalten hat. Im Gegensatz zur trockenen Versilberung liefert die Imprägnierung mit Protargol Strukturen um die Basalkörper, Zellkerne und Mikrofibrillen. Protargol stellt so die Anordnung der Wimpern oder Cirren dar. Es ist bis heute nicht genau geklärt, wie die Imprägnierung funktioniert. Dies ist erschwert durch die verschiedenen Schritte der Imprägnierung, ausgehend von der Fixierung, über ein Bleichen der Zellen bis zur Entwicklung der Versilberung.
Verschiedene Arbeiten beschäftigen sich mit der Frage welche Peptone als Ausgangsstoff zur Herstellung eines brauchbaren Silber-Präparats geeignet sind. Hatte man ein brauchbares Präparat gefunden, wurde eine Weiterentwicklung zeitweilig ausgesetzt. Es wurde im Laufe der Zeit jedoch klar, dass bereits durch veränderte Herstellungsprozesse ein Präparat eines Herstellers, das einmal funktionierte, nach einigen Jahren eventuell keine brauchbaren Ergebnisse mehr lieferte. Daher finden sich in der Literatur immer wieder neue Rezepturen. Ein fertiges Protargolpräparat für die Elektronenmikroskopie (unbekannte Zusammenstellung, Konzentration 1%), das ich als fertige Lösung über einen Online-Versender aus den USA beziehen konnte, ergab in Versuchen Resultate, die dem erwarteten Ergebnis ähneln.
Die Schwierigkeit der Findung eines Ersatzpräparats und die Herstellungsanweisung für einen brauchbaren Silberalbumin-Komplex wird sodann von Pan et al. (2013) neu diskutiert und erneut ausführlicher beschrieben. Das Silberalbumin wird aus Silbernitrat, Ammoniakwasser und Pepton durch mehrfache Bearbeitung und Reinigung mit Aceton gewonnen. Die Imprägnierlösung wird aus dem resultierenden nicht näher identifizierten Komplex von Silber mit dem Pepton in wässriger Lösung gebildet, dessen wirksame Komponenten bis heute nicht im Detail aufgeklärt sind. Die Wahl eines geeigneten Peptons als Ausgangsprodukt für die Herstellung im Hauslabor bleibt offenbar bis heute ein kritischer Faktor, den es auszuprobieren gilt. Die einschlägigen Firmen listen etliche Peptone, von denen nur wenige brauchbar sind. In der Arbeit von Pan et al. (2013) werden fünf Peptone verschiedener Firmen als geeignet benannt. Das dürfte jedoch nicht in Stein gemeißelt bleiben. Der Silberalbuminkomplex wird in einer Lösung von 0,4-1,0% angewandt. Das nach neuerer Vorschrift hergestellte Präparat stellt offenbar ein effektives Mittel dar, für das eine Konzentration von 0,4% zur Imprägnierung empfohlen wird.
Gezeigt ist hier eine neu entdeckte, grüne Art von Spirostomum sp. (Publikation in Vorbereitung). Die dominant goldbraune Färbung resultiert aus der Fixierung und Behandlung mit dem Protargolpräparat und ist typisch für diese Methode. In der Zellmitte ist etwas abgedunkelt der große Zellkern zu erkennen. Darum herum winden sich viele Reihen der Wimpern spiralig. Spirostomum Arten kontrahieren gerne bei der Fixierung, wobei die bei normalem Schwimmverhalten eher longitudinal angeordneten Wimperreihen nun spiralig kontrahiert erscheinen. Textiles Mikroplastik in mikroskopischen Präparaten ist heute fast unvermeidlich, wie die im Präparat eingeschlossene blaue Faser rechts oben in der Ecke zeigt.
Abbildung 2: Eine neu entdeckte Art eines Spirostomum sp., Protargolimprägnierung nach Fixierung und Anfertigung eines Dauerpräparats in Kanadabalsam. Man erkennt spiralig gewunden die Anordnung der Cilienreihen sowie den in vivo moniliformen Zellkern. Fokusstack aus 15 Aufnahmen mit einem Objektiv 40x.
Eine weitere Hürde für eine gelungene Imprägnierung ist die Wahl des richtigen Fixiermittels für die zu dokumentierende Spezies. Nicht alle Fixiermittel arbeiten für alle Gattungen gleich gut. Die meisten Methoden verlangen den Einsatz von Fixiermitteln auf Basis von Formaldehyd oder Glutaraldehyd. Weitere Ingredenzien der Fixiermittel sind Essigsäure sowie Pikrinsäure in wässriger Lösung oder Sublimat (Quecksilber-Chlorid). Ältere Methoden nutzen noch Fixierer, die Chromsäure oder Kobaltsalze enthalten. Für besonders heikle Arten wird eine Stabilisierung der Zellen durch Räucherung mit Osmium-Tetroxid (Vorfixierung) empfohlen. Diese Substanz wird üblicherweise auch in der Elektronenmikroskopie verwandt. Funktionierende Ersatzstoffe für die Fixierung sind bis heute nicht bekannt. Die Fixierung der Wimpertiere und ein guter Erhalt der Zellen ist sehr schwierig und für sich genommen ein hochgradig experimentelles Feld – vor allem bei neu entdeckten Arten. Man benötigt einen guten Zugang zur Fachliteratur, Kontakte zu der Institutseinrichtung einer Universität oder eine vergleichbare Möglichkeit. Darüberhinaus benötigt man Zeit zum Experimentieren, eine hohe Frustrationstoleranz und den Willen nicht aufzugeben. Unterm Strich ist die Imprägnierung mit Protargol über den gesamten Prozess mit denkbar vielen Fehlerquellen behaftet und erfordert einige Übung - Fehlschläge inbegriffen.
Die Methode der Imprägnierung mit Protargol ist nichts für Ungeduldige. Wer diese Methode anwenden möchte, ohne sie in einem Praktikum unter kundiger Führung erlernt zu haben, sollte eines beherzigen: Aufgeben gilt nicht! In der momentanen experimentellen Phase gilt es den Entwickler noch zu verbessern, um in die Abbildungen der eigentlichen adoralen Membranellenzone meiner gefundenen Arten von Spirostomum spp. eventuell noch besser herauszuarbeiten.
Abbildung 3: Dasselbe Individuum von Spirostomum sp., wie in Abb. 2. Hier gezeigt jedoch eine Einzelaufnahme mit dem Fokus auf das Peristom (Mundfeld), das hier nach Kontraktion spiralig gewunden um den Körper erscheint. Bei dieser Art hat das Peristom etwa die halbe Körperlänge.
Diskussion
Die verschiedenen Methoden der Färbung bzw. Imprägnierung mit Silber demonstrieren verschiedene Strukturen der Wimpertiere. Der Grund liegt in der unterschiedlichen chemischen Art und Weise, wie die verschiedenen angewandten Silberpräparate mit Fibrillensystemen oder Zellproteinen anderer Organellen interagieren. Daher sind sie untereinander nicht vergleichbar oder austauschbar. Ursprünglich glaubte man mit der trockenen Versilberung ein Nervensystem in den Ciliaten gefunden zu haben. Spätere, elektronenmikroskopische Untersuchungen legen jedoch nahe, dass es sich um gefärbte Fibrillen handelt, die teils dem intrazellulären Bewegungsapparat des Ciliensystems zuzuordnen sind. Protargolmethoden hingegen färben eher Strukturen der Basalkörper der Cilien und zeigen somit deren Anordnung. In der älteren Literatur zur Beschreibung der Arten, wie etwa zu lesen in der Monographie zu Tetrahymena spp. (Elliott, 1973), wurden meist noch Methoden angewandt, welche gänzlich anders funktionieren, etwa die Vorschriften von Chatton-Lwoff oder Corliss. Vorsicht ist auch geboten, da gelegentlich Arten innerhalb der Gattung mit unterschiedlichen Methoden gefärbt gegenüber gestellt werden. Möchte man daher Strukturen einer bestimmten Art vergleichen mit Literaturbefunden, um die eigene Art genau zu bestimmen, falls deren Silberstrukturen bekannt sind, bleibt einem keine andere Wahl, als die entsprechende ältere Methode für diese spezielle Gattung ebenfalls zu erlernen. Daher ist die Notwendigkeit der Versilberung sicherlich auch kritisch zu betrachten, denn die verschiedenen über die Jahrzehnte entwickelten Methoden sind untereinander nicht vergleichbar.
Ausblick
Die Versilberung ist bislang gefordert für die Dokumentation einer (zumeist neu beschriebenen) Spezies. So wird auch in der neueren Literatur die Versilberung angewandt, um die regionale oder auch globale Verteilung der Arten anhand von Typusbelegen für Erstfunde in anderen Regionen der Erde zu dokumentieren. Neben histologischen Färbungen zählen Versilberungen auch zu den wenigen Methoden, die Dauerpräparate von Ciliaten liefern. Jede Art hält eine andere Herausforderung bereit. Da eine Kultur für viele Ciliaten obendrein schwierig ist, hat man oft nur einzelne Exemplare zur Hand. So es gilt unter den bekannten Methoden obendrein diejenige zu finden, welche mit der gefundenen Art funktioniert. Von allen scheint die Protargolmethode in der Breite am besten zu funktionieren. Für Vergleiche mit älterer Literatur wird man diese älteren Methoden anwenden müssen. Für die Bestimmung einzelner Individuen ist die Versilberung nicht praxistauglich, da sie aufwendig ist und eine gewisse Menge an Typusmaterial erfordert. Längst erforscht man neue Methoden zur Darstellung der Strukturen von Ciliaten auch mit Mitteln der Fluoreszenzanalyse. Details der hier gezeigten, neue Spirostomum Art werden auf der 40. Jahrestagung der Deutschen Gesellschaft für Protozoologie präsentiert.
Danksagung
Besonderer Dank gilt Wilhelm Foissner (✝︎2020) und Catherine Fehse (INRES, Universität Bonn), bei denen ich die trockene Versilberung lernen durfte. Ebenfalls Dank gebührt Helmut Berger, der mir meine Fragen zur Imprägnierung mit Protargol geduldig beantwortete (private Korrespondenz per eMail).
Nachtrag: Ebenfalls möchte ich Dr. Zhishuai "Dex" Qu danken, der mir dieser Tage noch viele Tipps und ein aktualisiertes Protokoll der unten zitierten Arbeit von Pan et al. (2013) aus Song's Lab (China) zur Verfügung stellte.
Literatur
- Klein B.M., 1926. Zool. Anz. 67, 1.
- Foissner, W., 1969. Reaktionen des Silberliniensystems der Ciliaten auf mechanische Insulte. Protoplasma, 68(4), 433-456.
- Foissner, W., 1975. Der elektronenmikroskopische Nachweis der fibrillären Natur des Silberliniensystems bei peritrichen Ciliaten. Zeitschrift für Naturforschung C, 30(11-12), 818-822.
- Foissner, W. et al., 1991: Taxonomische und ökologische Revision der Ciliaten des Saprobiensystems. Bayerisches Landesamt für Wasserwirtschaft.
- Foissner, W., 1991. Basic light and scanning electron microscopic methods for taxonomic studies of ciliated protozoa. European Journal of Protistology, 27(4), 313-330.
- Pan, X., Bourland, W. A., Songa, W., 2013. Protargol Synthesis: An In-house Protocol. Journal of Eukaryotic Microbiology 60, 609–614.
- Elliott, A. M., 1973: Biology of Tetrahymena. Dowden, Hutchinson & Ross Inc., Stroudsburg, Pennsylvania.
- Bauer, T., 2021. Ciliates in the "Maare" (mires) of Bornheim: Local diversity of Spirostomum spp. 40th annual meeting of the Deutsche Gesellschaft für Protozoologie (in Vorbereitung).